Phương pháp so sánh tính base của Amin
Cấu trúc phân tử của amoniac và các amin
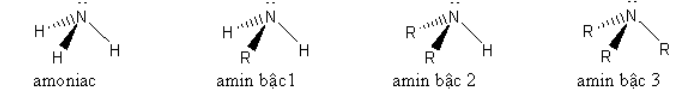
Trên nguyên tử nitơ đều có cặp electron tự do nên amoniac và các amin đều dễ dàng nhận proton. Vì vậy amoniac và các amin đều có tính base
So sánh lực base
– Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ.
p-NO2-C6H4NH4 < C6H5NH2 < NH3 < CH3NH2 < C2H5NH2 < C3H7NH2
– Amin có càng nhiều gốc đẩy e thì tính bazơ càng mạnh, amin có càng nhiều gốc hút e thì tính bazơ càng yếu.
(Rthơm)3N < (R thơm)2NH < RthơmNH2 < NH3 < Rno NH2 < (Rno)2NH < (Rno)3N
- Chú ý rằng với gốc Rno càng cồng kềnh thì ảnh hưởng không gian của nó càng lớn làm cản trở quá trình H+ tiến lại gần nguyên tử N nên (Rno)2NH < (Rno)3N sẽ không còn đúng nữa.
Chất chỉ thị màu
– Dung dịch metylamin và đồng đẳng của nó có khả năng làm xanh giấy quỳ tím hoặc làm hồng phenolphtalein do có tính bazơ mạnh hơn amoniac.
– Dung dịch của anilin và các amin thơm không làm đổi màu quỳ tím và phenolphtalein.
Bài tập đốt cháy Amin
- Phương trình đốt cháy amin tổng quát :
CnH2n+2-2k+aNa + 6n+2−2k+a4 O2 −→to nCO2 + 2n+2−2k+a2H2O + a2N2 (1)
Amin no mạch hở có công thức CnH2n+2+tNt
CnH2n+2+tNt + 6n+2+t4O2 −→to nCO2+2n+2+t2H2O+t2N2 (1)
a mol → an mol → a.2n+2+t2
→namin=nH2O−nCO21+t2
– Với amin no, đơn chức, mạch hở có :
namin=nH2O−nCO21,5, namin=2nN2 , C = nCO2namin , H = 2nH2Onamin
– Với amin đơn chức có: namin=2nN2
– Với amin no 2 chức: nH2O−nCO2=2namin=2nN2
Khi đốt cháy 1 amin ngoài không khí thì:
nN2 sau phản ứng = nN2 sinh ra từ phản ứng đốt cháy amin + nN2 có sẵn trong không khí
- Phương pháp giải:
– Sử dụng định luật bảo toàn nguyên tố
– Đối với bài toán đốt cháy hỗn hợp các amin sử dụng công thức trung bình.
– Đối với bài tập đốt cháy amin bằng hỗn hợp O2 và O3 thì nên quy đổi hỗn hợp thành O.
Amin phản ứng với acid và dung dịch muối
Amin tác dụng với acid sinh ra muối amoni
CH3NH2 + HCl → CH3NH3Cl
Metylamoni clorua
2CH3CH2NH2 + H2SO4 → (CH3CH2NH3)2SO4
Etylamoni sunfat
C6H5NH2 + HCl → C6H5NH3Cl
Phenylamoni clorua
Vì amin là những bazơ yếu nên các muối của amin dễ dàng tác dụng với kiềm mạnh giải phóng amin (tương tự NH3)
CH3NH3Cl + NaOH → CH3NH2 + NaCl + H2O
Phương pháp giải
– Sử dụng công thức của amin dạng RNH2
– Ta có : số nhóm chức amin = nH+namin
– Sử dụng tăng giảm khối lượng: nHCl = mm′−mamin36,5
– Sử dụng bảo toàn khối lượng : mmuối = mamin + maxit
Amin tác dụng với muối của kim loại
3CH3NH2+FeCl3+3H2O→Fe(OH)3+3CH3NH3Cl
3CH3CH2NH2+AlCl3+3H2O→Al(OH)3+3CH3CH2NH3Cl
+ amin không hòa tan được hiđroxit lưỡng tính (Al(OH)3, Zn(OH)2, …)
+ amin có khả năng tạo phức tương tự NH3
+ anilin và những amin thơm không có phản ứng này
- Phương pháp giải:
– Đặt công thức amin là RNH2.
– Chú ý tỉ lệ số mol của amin và các muối cũng như kết tủa sinh ra.
Amin tác dụng với HNO2 và phản ứng thế ở nhân thơm
Amin tác dụng với HNO2
– Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
Ví dụ : C2H5NH2+HONO→C2H5OH+N2+H2O
– Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 – 5oC) cho muối điazoni:
C6H5NH2+HONO+HCl −−−→0−5oC C6H5N2+Cl−+2H2O
phenylđiazoni clorua
– Muối điazoni có vai trò quan trọng trong tổng hợp hữu cơ, đặc biệt là tổng hợp phẩm nhuộm azo.
Phản ứng thế ở nhân thơm
Giải thích : Do ảnh hưởng của nhóm NH2 (tương tự nhóm –OH ở phenol), ba nguyên tử H ở các vị trí ortho và para so với nhóm –NH2 trong nhân thơm của anilin bị thay thế bởi ba nguyên tử brom.
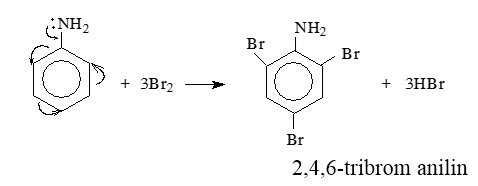
+ Phản ứng này dùng nhận biết anilin vì tạo ra kết tủa trắng 2, 4, 6-tribromanilin.
+ Amin không no có phản ứng cộng làm mất màu dung dịch brom tương tự anken, ankin, …
Trung tâm học tiếng Anh online, tiếng Anh giao tiếp, luyện thi Toeic, Ielts: https://local.google.com/place?id=17925709090940119267&use=posts&lpsid=5267420619577773623
#hoalop12 #baitapphanung #phanunghoahoc #disaccharide #hochay #lythuyethoa12 #tracnghiemhoa12 #hoa12nangcao #baitaphoa12 #cachgiaihoa12 #hocgioihoa
 Cộng đồng sống trọn từng giây
Cộng đồng sống trọn từng giây